VnDoc xin giới thiệu các bạn Giải bài tập hóa 9 bài 8: Một số Bazơ quan trọng với lời giải chi tiết rõ ràng giúp các bạn học sinh nắm chắc được những kiến thức căn bản của bài học để hiểu rõ hơn về một số bazơ quan trọng trong môn Hóa. Mời các bạn tham khảo tài liệu dưới đây
>> Bài trước đó: Giải Hóa 9 Bài 7: Tính chất hóa học của Bazơ
A. Tóm tắt lý thuyết Hóa 9 bài 8
I. Natri hiđroxit
- Là chất rắn, không màu, hút ẩm mạnh, tan nhiều trong nước, tỏa nhiệt
- Dung dịch NaOH có tính nhờn, làm bục vải giấy, làm mòn da, còn được gọi là dung dịch xút hoặc xút ăn da.
Làm đổi màu chất chỉ thị
Quỳ tím chuyển thành xanh.
Dung dịch phenolphthalein không màu thành màu hồng.
Tác dụng với axit (Tạo thành muối và nước): NaOH + HCl → NaCl + H2O
Tác dụng với oxit axit (tạo thành muối và nước): 2NaOH + CO2 → Na2CO3 + H2O
Có nhiều ứng dụng rộng rãi trong công nghiệp và đời sống
- Sản xuất xà phòng, chất tẩy rửa, bột giặt
- Sản xuất tơ nhân tạo
- Sản xuất giấy
- Chế biến dầu mỏ
- Dùng nhiều trong ngành công nghiệp hóa chất khác
Sản xuất NaOH
Phương pháp: điện phân dung dịch NaCl bão hòa
2NaCl + 2H2O  2NaOH + H2 + Cl2 (có màng ngăn)
2NaOH + H2 + Cl2 (có màng ngăn)
2. Canxi hiđroxit – Thang pH
Tính chất hóa học
Ca(OH)2 mang đầy đủ tính chất hóa học của một dung dịch bazơ tan.
- Làm đổi màu chỉ thị: quỳ tím chuyển thành màu đỏ, phenolphtalenin thành màu hồng
- Tác dụng với axit (tạo ra muối và nước)
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
- Tác dụng với oxit axit (tạo ra muối và nước)
Ca(OH)2 + CO2 → CaCO3 + H2O
3. Ứng dụng
Làm vật liệu trong xây dựng
Khử chua đất trồng trọt
Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật,…
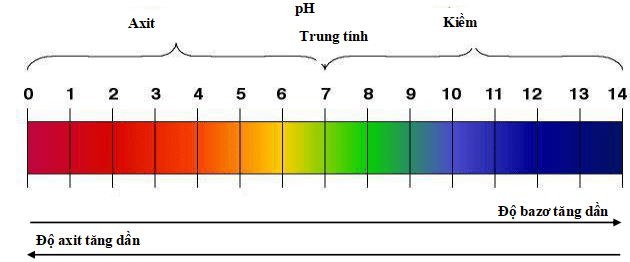
Thang pH
B. Giải bài tập Hóa 9 Bài 8 (tiết 1)
Bài 1 Trang 27 SGK Hóa 9
Có 3 lọ không nhãn, mỗi lọ đựng chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học (nếu có).
Đáp án hướng dẫn giải chi tiết bài tập
Trích mẫu thử và đánh số thứ tự
Hòa tan mẫu thử từng chất vào nước để tạo thành các dung dịch tương ứng. Cho quỳ tím vào mỗi dung dịch: Nếu quỳ tím chuyển sang màu xanh là NaOH và Ba(OH)2, nếu quỳ tím không đổi màu là NaCl.
Như vậy đã tìm được Nacl, tiếp tục tìm cách nhận biết: NaOH và Ba(OH)2
Dẫn khí CO2 vào hai dung dịch bazơ còn lại: Nếu có kết tủa xuất hiện là Ba(OH)2, nếu không kết tủa là NaOH.
Ba(OH)2 + CO2 → BaCO3↓ + H2O
2NaOH + CO2 → Na2CO3 + H2O
Tham khảo thêm cách khác:
Trích mẫu thử và đánh số thứ tự. Hòa tan các mẫu thử vào H2O thành dung dịch mẫu thử tương ứng:
- Dùng quỳ tím cho vào từng mẫu thử
Mẫu nào làm quỳ tím hóa xanh đó là NaOH và Ba(OH)2.
Còn lại là NaCl không có hiện tượng.
- Cho H2SO4 vào các mẫu thử NaOH và Ba(OH)2
Mẫu nào có kết tủa trắng đó là sản phẩm của Ba(OH)2
Phương trình hóa học:
Ba(OH)2 + H2SO4 → BaSO4↓ (trắng) + 2H2O
Không hiện tượng đó là NaOH.
Bài 2 Trang 27 SGK Hóa 9
Có những chất sau: Zn, Zn(OH)2, NaOH, Fe(OH)3, CuSO4, NaCl, HCl.
Hãy chọn chất thích hợp điền vào mỗi sơ đồ phản ứng sau và lập phương trình học:
a) ….. → Fe2O3 + H2O;
b) H2SO4 + … → Na2SO4 + H2O;
c) H2SO4 + … → ZnSO4 + H2O;
d) NaOH + …. → NaCl + H2O;
e) ….. + CO2 → Na2CO3 + H2O.
Đáp án hướng dẫn giải chi tiết bài tập
a) 2Fe(OH)3 → Fe2O3 + 3H2O;
b) H2SO4 + 2NaOH → Na2SO4 + 2H2O;
c) H2SO4 + Zn(OH)2 → ZnSO4 + 2H2O;
d) NaOH + HCl → NaCl + H2O;
e) 2NaOH + CO2 → Na2CO3 + H2O
Bài 3 Trang 27 SGK Hóa 9
Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4 gam NaOH, sản phẩm là muối Na2CO3.
a) Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
b) Hãy xác định khối lượng muối thu được sau phản ứng.
Đáp án hướng dẫn giải chi tiết bài tập
Số mol: nCO2 =1,568/22,4 = 0,07 mol; nNaOH =6,4/40 = 0,16 mol
Phương trình hóa học:
CO2 + 2NaOH → Na2CO3 + H2O
Ban đầu: 0,07 0,16 0 (mol)
Phản ứng: 0,07 → 0,14 0,07
Sau pứ: 0 0,02 0,07
a) Chất còn dư là NaOH và dư: 0,02 . 40 = 0,8 g
b) Khối lượng muối Na2CO3 tạo thành là: 0,07 . 106 = 7,42 g.
>> Bài tiếp theo tại: Giải Hóa 9 Bài 8: Một số Bazơ quan trọng (tiếp theo)
C. Giải sách bài tập hóa 9 bài 8: Một số Bazơ quan trọng
Ngoài các dạng câu hỏi bài tập sách giáo khoa hóa 9 bài 8, để nâng cao củng cố cũng như vận dụng tốt kiến thức lý thuyết hóa 9 bài 8. Các bạn học sinh cần làm thêm các dạng câu hỏi bài tập sách bài tập hóa 9 bài 8. Để giúp bạn đọc nắm được các phương pháp giải bài tập. VnDoc đã biên soạn hướng dẫn bạn đọc giải bài tập SBT hóa 9 bài 8 tại:
- Giải Sách bài tập Hóa học 9 bài 2: Một số Bazơ quan trọng
D. Trắc nghiệm Hóa 9 bài 8 Một số Bazơ quan trọng
Câu 1: Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Câu 2: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Câu 3: Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím
B. HCl
C. NaCl
D. H2SO4
Câu 4: NaOH có tính chất vật lý nào sau đây?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt
C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt
D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Mời các bạn tham khảo trọn bộ câu hỏi trắc nghiệm Hóa 9 bài 8 tại:
- Trắc nghiệm Hóa học 9 bài 8
Giải Hóa 9: Một số Bazơ quan trọng. Trên đây VnDoc đã hướng dẫn trả lời các câu hỏi trong SGK Hóa 9, hiểu rõ hơn về một số tính chất Bazơ từ đó vận dụng vào giải các các bài tập. Mời các bạn cùng tham khảo
- Giải bài tập bài tập trang 21 SGK Hóa lớp 9: Luyện tập tính chất hóa học của oxit và axit
- Giải bài tập trang 25 SGK Hóa lớp 9: Tính chất hóa học của Bazơ
………………………………………
Ngoài Giải Hóa 9: Một số Bazơ quan trọng. Mời các bạn học sinh còn có thể tham khảo các Trắc nghiệm Hóa học 9, Giải sách bài tập Hóa 9, Giải bài tập Hóa học 9 các môn Toán, Văn, Anh, Lý, Địa, Sinh mà chúng tôi đã sưu tầm và chọn lọc. Với tài liệu lớp 9 này giúp các bạn rèn luyện thêm kỹ năng giải đề và làm bài tốt hơn. Chúc các bạn học tốt.
Chào mừng bạn đến với PRAIM, - nền tảng thông tin, hướng dẫn và kiến thức toàn diện hàng đầu! Chúng tôi cam kết mang đến cho bạn một trải nghiệm sâu sắc và tuyệt vời về kiến thức và cuộc sống. Với Praim, bạn sẽ luôn được cập nhật với những xu hướng, tin tức và kiến thức mới nhất.