Toluen là gì
 Toluene là một hợp chất tự nhiên có nguồn gốc chủ yếu từ quá trình dầu mỏ hoặc hóa dầu. Toluene là một thành phần phổ biến trong các sản phẩm xăng, keo dán và sơn. Toluene là một chất lỏng không màu, không tan trong nước và có mùi như chất pha loãng sơn. Nó là một chất lỏng không màu đơn chất, bao gồm một nhóm CH3 được gắn vào một nhóm phenyl.
 Công thức hóa học của toluen C6H5CH3
Tính chất vật lý của toluen
- Nhiệt độ sôi của toluen 111 độ C
- Khối lượng riêng của toluen 92,141 g/mol
- Điểm nóng chảy của Toluene −95 °C
- Mật độ Toluen 0,87 g/mL
Tính chất hóa học của toluen
 Toluene không ăn mòn, dễ cháy và không hòa tan trong nước, nhưng hòa tan trong hầu hết các dung môi hữu cơ.
 Nhóm metyl trong toluen bị halogen hóa trong điều kiện không có gốc tự do. Ví dụ, N-bromosuccinimide tức là NBS được đun nóng bằng toluene với sự có mặt của AIBN tạo ra benzyl bromide. Chuyển đổi tương tự có thể bị ảnh hưởng bởi brom nguyên tố khi có tia cực tím hoặc thậm chí là ánh sáng mặt trời. Toluene có thể dễ dàng bị brom hóa bằng cách xử lý nó với HBr và H2O2 khi có ánh sáng.
 C6H5CH3 + Br2 → C6H5CH(Br)2 + HBr
 C6H5CH2Br + Br2 → C6H5CHBr2 + HBr
Điều chế toluen
 Toluene được tìm thấy tự nhiên trong dầu thô và là một sản phẩm phụ trong quá trình sản xuất xăng. Ngoài ra, nó thu được như một sản phẩm phụ trong sản xuất than cốc từ than đá.
 Sản xuất Toluene ở cấp độ công nghiệp là không tốn kém. Nó được tổng hợp theo nhiều phương pháp khác nhau. Ví dụ, phản ứng của benzen với metyl clorua với sự có mặt của nhôm clorua (axit Lewis) để tạo ra toluen:
 C6H5H + CH3Cl → C6H5CH3 + HCl
Ứng dụng của toluen
 Toluene là một dung môi phổ biến được sử dụng cho những sản xuất sau đây:
- Keo dán
- Sơn
- Chất pha loãng sơn
- Mực in
- Cao su
- Thợ thuộc da
- Keo silicon
- Chất phản ứng hóa học
- Sơn mài
 Hiện nay Vua hóa chất là đơn vị phân phối và bán lẻ hóa chất toàn quốc. Quý khách có nhu cầu mua hóa chất. Hãy liên hệ với chúng tôi để được tư vấn báo giá hóa chất toluene thời điểm hiện tại !!!
 Những tên gọi khác của sản phẩm
 TOLUEN, DUNG MÔI TOLUEN, C7H8, CH3C6H5, METYL BENZEN, METHYL BENZEN, TOLUOL, TOLUENE, Metylbenzen, Phenylmetan
 Toluene msds
 https://www.labchem.com/tools/msds/msds/LC26170.pdf
 Toluene cas number
 108-88-3
 Công thức phân tử của toluen
 C7H8
 Toluen có tham gia phản ứng trùng hợp không
 Toluene có thể tham gia các phản ứng trùng hợp nhưng điều kiện phản ứng cần phải được kiểm soát kỹ lưỡng để đảm bảo sản phẩm đạt chất lượng mong muốn.
 Toluen có độc không
 Toluene là một hợp chất độc hại nếu sử dụng sai cách hoặc bị tiếp xúc quá mức. Nó có thể gây ra các triệu chứng như đau đầu, chóng mặt, mệt mỏi, mất cân bằng và nôn mửa. Nếu được sử dụng trong điều kiện an toàn và đúng cách, nó có thể được sử dụng an toàn trong các ứng dụng công nghiệp và hộ gia đình.
 Toluen có tan trong nước không
 Toluene không hòa tan hoàn toàn trong nước, chỉ hòa tan một lượng rất ít. Tuy nhiên, nó có thể hòa tan tốt trong các dung môi hữu cơ khác như etanol, axit axetic, ether và chloroform.
 C7h8 có số đồng phân thơm là
 C7H8 có số đồng phân thơm là 2, bao gồm ortho-xilên và meta-xilên.
 Toluen có làm mất màu dung dịch kmno4 không
 Khi đun nóng toluen (C7H8) với sự có mặt của thuốc tím (KMnO4), nó sẽ phản ứng với KMnO4, dẫn đến quá trình oxy hóa toluen để tạo thành axit benzoic và/hoặc các sản phẩm liên quan khác. Phản ứng tỏa nhiệt và có thể tạo ra nhiệt. Tuy nhiên, chưa chắc toluen đã làm mất màu dung dịch KMnO4.
 Toluen có làm mất màu dung dịch brom không
 Toluen (C7H8) không phản ứng với brom (Br2) khi không có chất xúc tác cũng như ở điều kiện thường nên không làm dung dịch brom chuyển màu.
 Toluen có tác dụng với naoh không
 Toluen (C7H8) là một hiđrocacbon và không phản ứng với natri hiđroxit (NaOH) ở điều kiện thường.
Phương trình hóa học tiêu biểu của toluen
 toluen + br2 xúc tác fe
 Nếu cho toluen phản ứng với brom trong điều kiện có bột sắt sẽ thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí para và ortho.
 toluen br2 hiện tượng mất màu nước brom
 Toluen + br2 tỉ lệ 1 3
 C7H8 + 3Br2 → C6H5CH2Br + 3HBr
 toluen br2 ánh sáng, toluen br2 tỉ lệ 1 1
 C6H5CH3 + Br2 ( ánh sáng ,1:1 ) -> C6H5CH2Br + HBr
 toluen br2 trong ccl4
 C7H8 + Br2 → C7H7Br + HBr
 C7H8 + 2KMnO4 + 3H2SO4 → 7CO2 + 2K2SO4 + 2MnSO4 + 3H2O
 Toluen kmno4 hiện tượng : Khi cho toluen (C7H8) phản ứng với thuốc tím (KMnO4), dung dịch KMnO4 có màu tím nhạt dần và dung dịch chuyển sang màu nâu do KMnO4 bị khử. Điều này cho thấy phản ứng oxi hóa khử đang xảy ra và KMnO4 đang được sử dụng hết làm chất oxi hóa.
 C7H8 + 2KMnO4 + 3NaOH → 7CO2 + 2K2CO3 + 2MnO2 + 3H2O + 3Na2SO4
 Toluen ra benzyl bromua
 C7H8 + Br2 + FeBr3 → C6H5CH2Br + HBr + FeBr2
 Toluen + cl2 ánh sáng xảy ra phản ứng, toluen cl2 bột fe
 C7H8 + Cl2 → C7H7Cl + HCl
 Toluen + h2 xúc tác ni
 C7H8 + H2 → C7H14
 Toluen + hno3 tỉ lệ 1 3 tạo ra thuốc nổ TNT
 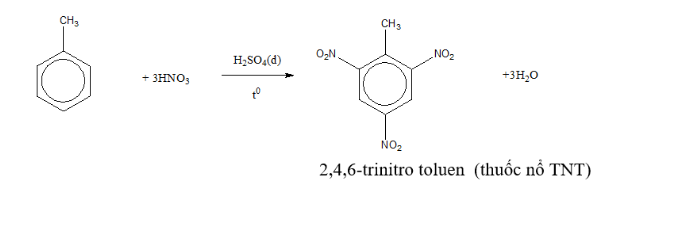
 Cho toluen phản ứng với hno3 đặc xúc tác h2so4 tỉ lệ 1 1
 C7H8 + HNO3 → C7H7NO2 + H2O
 Toluen + o2
 3O2 + 2C6H5CH3 → 2H2O + 2C6H5COOH
 C7H8 ( agno3/nh3 ) -> C7H(8-x)Agx
 C6H5CH3 + HBr -> không phản ứng
 Toluen ra benzyl clorua
 HCl + C7H8 → C7H7Cl + H2
 Heptan ra toluen
 CH3(CH2)5CH3 ( xúc tác Cr2O3/Al2O3, 500 oC ) -> toluen + 4H2
 
 dd khan td mol chính c7h8+br2 chiếu as sơ đồ benzene c7h8+kmno4+h2so4 oxidation with reacts bromination of propargyl 80 toluolo englisch solvent toluen+cl2 cộng hv 3cl2 2cl2 dư 3hno3 c7h8+hno3 c7h8+hno3+h2so4 methylbenzene structure is also known common name carboxylate nhiêu đp 3h2 c7h8+h2 c7h8o2 c7h8+o2 agno3 nh3 br ctct cấu ctpt gọn merck price today chemical formula viết
Chào mừng bạn đến với PRAIM, - nền tảng thông tin, hướng dẫn và kiến thức toàn diện hàng đầu! Chúng tôi cam kết mang đến cho bạn một trải nghiệm sâu sắc và tuyệt vời về kiến thức và cuộc sống. Với Praim, bạn sẽ luôn được cập nhật với những xu hướng, tin tức và kiến thức mới nhất.

















