Hướng dẫn giải Bài 6. Luyện tập: Cấu tạo vỏ nguyên tử sgk Hóa Học 10. Nội dung bài Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10 bao gồm đầy đủ phần lý thuyết và bài tập, đi kèm công thức, phương trình hóa học, chuyên đề… có trong SGK để giúp các em học sinh học tốt môn hóa học 10, ôn thi tốt nghiệp THPT quốc gia.
A – KIẾN THỨC CẦN NẮM VỮNG
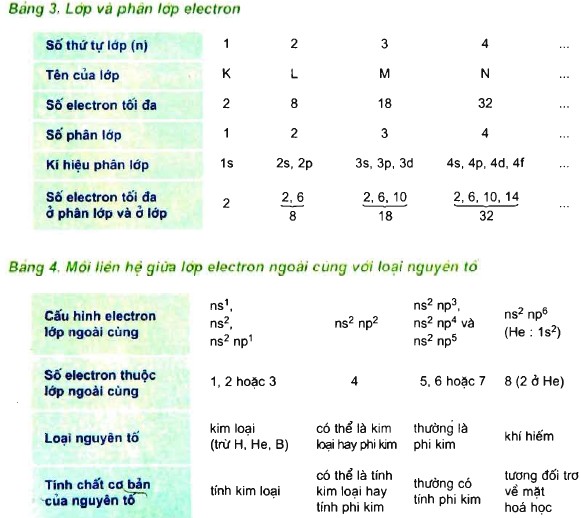
B – BÀI TẬP
Dưới đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10 đầy đủ và ngắn gọn nhất. Nội dung chi tiết bài giải các bài tập các bạn xem sau đây:
1. Giải bài 1 trang 30 hóa 10
Thế nào là nguyên tố $s, p, d, f$ ?
Bài giải:
– Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
– Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
– Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
– Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
2. Giải bài 2 trang 30 hóa 10
Các electron thuộc lớp K hay lớp L liên kết với hạt nhân chặt chẽ hơn? Vì sao?
Bài giải:
Các electron thuộc lớp K liên kết với hạt nhân chặt chẽ hơn lớp L vì gần hạt nhân hơn và mức năng lượng thấp hơn.
3. Giải bài 3 trang 30 hóa 10
Trong nguyên tử, những electron của lớp nào quyết định tính chất hoá học của nguyên tử nguyên tố đó ? Cho thí dụ.
Bài giải:
Trong nguyên tử, những electron ở lớp ngoài cùng quyết định tính chất hoá học của nguyên tử nguyên tố.
Thí dụ: Liti, natri có 1e ở lớp ngoài cùng nên thể hiện tính chất của kim loại, oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng nên thể hiện tính chất của phi kim.
4. Giải bài 4 trang 30 hóa 10
Vỏ electron của một nguyên tử có 20 electron. Hỏi:
a) Nguyên tử đó có bao nhiêu lớp electron ?
b) Lớp ngoài cùng có bao nhiêu electron ?
c) Nguyên tố đó là nguyên tố kim loại hay phi kim ?
Bài giải:
Cấu hình electron: 1s2 2s2 2p5 3s2 3p6 4s2.
a) Nguyên tử có 4 lớp electron.
b) Lớp ngoài cùng có 2 electron.
c) Do nguyên tử nguyên tử có 2e lớp ngoài cùng nên nguyên tố đó là kim loại.
5. Giải bài 5 trang 30 hóa 10
Cho biết số electron tối đa ở các phân lớp sau:
a) 2s ; b) 3p ; c) 4s ; d) 3d.
Bài giải:
Số electron tối đa ở các phân lớp s, p, d, f tương ứng là 2, 6, 10, 14. Do đó, ta có:
a) 2s có tối đa 2e: 2s2.
b) 3p có tối đa 6e: 3p6.
c) 4s có tối đa 2e: 4s2.
d) 3d có tối đa 10e: 3d10.
6. Giải bài 6 trang 30 hóa 10
Cấu hình electron của nguyên tử photpho là 1s22s22p63s23p3. Hỏi :
a) Nguyên tử photpho có bao nhiêu electron ?
b) Số hiệu nguyên tử của photpho là bao nhiêu ?
c) Lớp electron nào có mức năng tượng cao nhất ?
d) Có bao nhiêu lớp electron, mỗi lớp có bao nhiêu electron ?
e) Photpho là nguyên tố kim loại hay phi kim ? Vì sao?
Bài giải:
a) Nguyên tử photpho có 15e.
b) Số hiệu nguyên tử của photpho là 15.
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) Có 3 lớp e. Lớp thứ nhất có 2 e, lớp thứ 2 có 8 e, lớp thứ 3 có 5 e.
e) Photpho là phi kim vì có 5e ở lớp ngoài cùng.
7. Giải bài 7 trang 30 hóa 10
Cấu hình electron của nguyên tử cho ta những thông tin gì ? Cho thí dụ.
Bài giải:
Cấu hình electron của nguyên tử cho ta biết: sự phân bố electron trên các lớp và phân lớp. Qua cấu hình electron ta biết được cấu tạo nguyên tử, vị trí của nguyên tố trong bảng tuần hoàn và tính chất hóa học đặc trưng của nguyên tố đó.
Thí dụ: Nguyên tố Na có cấu hình electron là: 1s2 2s2 2p6 3s1 .
– Cấu tạo nguyên tử: điện tích hạt nhân là 11+, nguyên tử có 3 lớp electron và có 1e ở lớp ngoài cùng.
– Vị trí của nguyên tố trong bảng tuần hoàn: ô số 11, chu kì 3, nhóm IA.
– Tính chất hóa học đặc trưng: do có 1e lớp ngoài cùng nên Na là một kim loại mạnh.
8. Giải bài 8 trang 30 hóa 10
Viết cấu hình electron đầy đủ cho các nguyên tử có lớp electron ngoài cùng là :
a) 2s1 ; b) 2s2 2p3 ; c) 3s23p6 ;
d) 3s2 3p3; e) 3s2 3p5; g) 2s2 2p6.
Bài giải:
Cấu hình electron đầy đủ cho các nguyên tử:
a) 1s2 2s1 ;
b) 1s2 2s2 2p3 ;
c) 1s2 2s2 2p6 ;
d) 1s2 2s2 2p6 3s2 3p3 ;
e) 1s2 2p6 3s2 3p5 ;
g) 1s2 2s2 2p6 3s2 3p6.
9. Giải bài 9 trang 30 hóa 10
Cho biết tên, kí hiệu, số hiệu nguyên tử của:
a) 2 nguyên tố mà nguyên tử có số electron lớp ngoài cùng là tối đa;
b) 2 nguyên tố mà nguyên tử có 1 electron ở lớp ngoài cùng;
c) 2 nguyên tố mà nguyên tử có 7 electron ở lớp ngoài cùng.
Bài giải:
a) ( _{10}^{20}textrm{Ne}) và ( _{18}^{40}textrm{Ar});
( _{10}^{20}textrm{Ne}) : 1s22s22p6 ⇒ có 8e lớp ngoài cùng.
( _{18}^{40}textrm{Ar}): 1s22s22p63s23p6 ⇒ có 8e lớp ngoài cùng.
b) ( _{11}^{23}textrm{Na}) và ( _{19}^{39}textrm{K});
( _{11}^{23}textrm{Na}) : 1s22s22p63s1 ⇒ có 1 e lớp ngoài cùng.
( _{19}^{39}textrm{K}) : 1s22s22p63s23p64s1 ⇒ có 1 e lớp ngoài cùng
c) ( _{17}^{35}textrm{F}) và ( _{17}^{35}textrm{Cl}).
( _{9}^{19}textrm{F}) : 1s22s22p5 ⇒ có 7e lớp ngoài cùng.
( _{17}^{35}textrm{Cl}) : 1s22s22p63s23p5 ⇒ có 7e lớp ngoài cùng.
Bài trước:
- Giải bài 1 2 3 4 5 6 trang 27 28 sgk Hóa Học 10
Bài tiếp theo:
- Giải bài 1 2 3 4 5 6 7 8 9 trang 35 sgk Hóa Học 10
Xem thêm:
- Để học tốt môn Toán 10
- Để học tốt môn Vật Lí 10
- Để học tốt môn Hóa Học 10
- Để học tốt môn Sinh Học 10
- Để học tốt môn Ngữ Văn 10
- Để học tốt môn Lịch Sử 10
- Để học tốt môn Địa Lí 10
- Để học tốt môn Tiếng Anh 10
- Để học tốt môn Tiếng Anh 10 (Sách Học Sinh)
- Để học tốt môn Tin Học 10
- Để học tốt môn GDCD 10
Trên đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 8 9 trang 30 sgk Hóa Học 10 đầy đủ, ngắn gọn và dễ hiểu nhất. Chúc các bạn làm bài môn hóa học 10 tốt nhất!
“Bài tập nào khó đã có giaibaisgk.com“
Chào mừng bạn đến với PRAIM, - nền tảng thông tin, hướng dẫn và kiến thức toàn diện hàng đầu! Chúng tôi cam kết mang đến cho bạn một trải nghiệm sâu sắc và tuyệt vời về kiến thức và cuộc sống. Với Praim, bạn sẽ luôn được cập nhật với những xu hướng, tin tức và kiến thức mới nhất.
- Cách Nấu Nước Lá Tía Tô Uống Đẹp Da, Tăng Sức Đề Kháng
- 100+ TỪ VỰNG VỀ TÍNH CÁCH CON NGƯỜI
- Văn mẫu lớp 10: Phân tích nhân vật Từ Hải trong bài Chí khí anh hùng (Dàn ý + 16 mẫu) 16 bài phân tích nhân vật Từ Hải
- Biển số xe đuôi 67 có nghĩa là gì? Giải mã ý nghĩa số 67
- Cách ốp mi mái để mi trống căng lửa
















